PI:
Prof. Achille Iolascon
Prof. Ordinario di Genetica Medica – Università degli Studi di Napoli Federico II
Dott.ssa Roberta Russo
Ricercatore in Genetica Medica – Università degli Studi di Napoli Federico II
Investigatori:
Dr.ssa Immacolata Andolfo
Specialista in Genetica Medica – Università degli Studi di Napoli Federico II
Dr.ssa Antonella Gambale
Specializzanda in Genetica Medica – Università degli Studi di Napoli Federico II
Durata del progetto: 3 anni
Costo del progetto: 249,000 euro
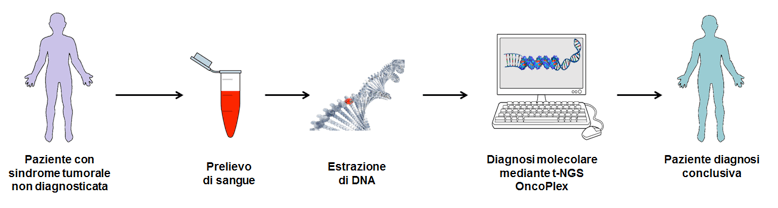
Razionale
In età pediatrica le neoplasie rappresentano una delle cause più importanti di morbilità e mortalità. L’incidenza di tumore maligno è pari a 164/milione nella fascia d’età 0-14 anni e pari a 269/milione nella fascia 15-19 anni (quinquennio 2003-2008). Circa un quarto dei casi di cancro in età pediatrica ha una base genetica. La presenza di familiarità per neoplasia fa porre sospetto diagnostico di predisposizione ereditaria ai tumori. È fondamentale riconoscere le famiglie con forme ereditarie di cancro, distinguendole da quelle in cui sono presenti casi sporadici, data la possibilità di avvalersi di diagnosi molecolare. Ciò è possibile attraverso un’adeguata valutazione dell’anamnesi oncologica del probando e delle eventuali manifestazioni cliniche associate. Il riconoscimento, nell’ambito della storia familiare, di neoplasie precoci o dello stesso spettro caratteristico, avvalora l’ipotesi diagnostica. Il fine d’identificare con precisione la familiarità e la predisposizione al cancro è quello di offrire un follow-up adeguato ai piccoli pazienti e alla loro famiglia, soprattutto per la possibilità di diagnosi precoce delle lesioni e miglioramento della prognosi.
Ad oggi mutazioni in circa 130 geni sono state associate a sindromi genetiche da predisposizione al cancro. Se da un lato ciò consente di effettuare una diagnosi molecolare mirata, dall’altro un numero così elevato di geni rende complessa la diagnosi differenziale. Sebbene il diagramma di flusso per la diagnosi di queste condizioni rientri nella normale pratica clinica, la diagnosi differenziale, la classificazione e la stratificazione dei pazienti affetti da tumori ereditari sono spesso molto difficili. È proprio in questo contesto che si collocano le nuove tecnologie genomiche. Con il termine NGS ci si riferisce a tecnologie di sequenziamento del DNA di nuova generazione. Tale tecnologia ha amplificato in modo significativo le opportunità di analisi del genoma, svolgendo un ruolo importante sia nella scoperta dei geni-malattia che nella pratica clinica di diagnosi genetica. L’applicazione principale nell’ambito diagnostico prevede l’utilizzo di un NGS mirato (targeted-NGS, t-NGS), in cui una frazione selezionata di geni viene sequenziata. L’utilizzo del t-NGS nella pratica diagnostica potrebbe avere diverse implicazioni sul diagramma di flusso per la diagnosi dei tumori ereditari: il test t-NGS potrebbe, infatti, diventare il test di primo livello, precedendo pertanto la biopsia ed altre procedure invasive, consentendo di porre diagnosi di sindrome da predisposizione oncologica a partire dalla prima lesione, senza aspettare l’insorgenza di lesioni multiple, che attualmente orienta la diagnosi.
Scopo
Lo scopo del presente progetto è di
Disegno sperimentale
Scopo 1. Lo sviluppo di un metodo diagnostico basato sulla metodica t-NGS consentirà di ottenere una diagnosi differenziale di sindromi genetiche da predisposizione al cancro in maniera rapida, affidabile e conveniente. A tal fine proponiamo per ciascun paziente il sequenziamento a livello del DNA germinale di un set selezionato di geni (circa 130) già associati a tumori ereditari. Allo scopo di validare il nostro approccio diagnostico, prevediamo in una prima fase di analizzare pazienti con diagnosi molecolare già nota. Successivamente abbiamo in programma di estendere l’analisi a tutti i pazienti con sospetto clinico di sindrome genetica da predisposizione tumorale.
Scopo 2. Il Registro dei pazienti con diagnosi molecolare per sindrome da predisposizione al cancro consentirà una migliore gestione dei protocolli. La gestione sistematica di tali protocolli infatti migliorerà l’iter di screening e diagnosi precoce, riducendo il numero di pazienti persi al follow-up. Permetterà inoltre una valutazione critica aggiornata dei protocolli stessi, consentendo di redigere nuove versioni per venire incontro alle esigenze del piccolo paziente e per sfruttare al meglio le innovazioni in ambito di diagnostica per immagini e biochimica non invasiva.
Prospettive future. Il completamento del progetto porterà all’identificazione di mutazioni, nuove e/o già identificate, associate a sindromi genetiche da predisposizione tumorale. I nostri risultati avranno un forte impatto in clinica. Infatti, oltre a conseguire una diagnosi definitiva in questi pazienti, conoscere la base genetica dei tumori ereditari può essere utile anche per stabilire la loro prognosi. La diagnosi molecolare, individuando una sindrome da predisposizione genetica, consentirà anche di indirizzare la terapia, prediligendo l’approccio chirurgico, minimizzando l’effetto “secondo tumore”, estremamente comune in tali soggetti in seguito all’approccio radio- e chemio-terapico.
Metodi
Scopo 1. La validazione del sistema diagnostico prevede l’utilizzo di due set di pazienti: (i) un set di validazione della metodica, ovvero pazienti a diagnosi già nota (n = 15); (ii) un set di pazienti a diagnosi non nota (n = 70).
Il set di 130 geni già associati a sindromi genetiche da predisposizione tumorale andranno a comporre il pannello t-NGS denominato OncoPlex. Il disegno del pannello sarà effettuato mediante il tool informatico Agilent SureDesign. Come sequenze target saranno selezionate regioni codificanti, UTRs, regioni regolatorie e 100 bp fiancheggianti i siti di splicing. L’arricchimento del target verrà eseguito sul DNA germinale ottenuto dal sangue periferico di pazienti da entrambi i suddetti set mediante HaloPlex Target Enrichment System (Agilent Technologies). Il sequenziamento verrà effettuato su piattaforma Illumina. L’analisi bioinformatica verrà eseguita utilizzando il software SureCall (Agilent Technologies). Le varianti selezionate e il pattern di segregazione saranno validati mediante sequenziamento diretto (metodo Sanger).
Scopo 2. I pazienti saranno suddivisi sulla base della mutazione riscontrata e sarà applicato un protocollo di follow-up dedicato. Ulteriore classificazione verrà eseguita sulla base dell’età, come da dati di letteratura. I risultati di tale follow-up saranno annualmente raffrontati con i dati presenti in letteratura. Saranno quindi valutati gli effetti del follow-up stesso (diagnosi di lesioni in epoca precoce) e saranno aggiornati sulla base delle nuovi approcci in ambito di diagnostica per immagini e biochimica non invasiva.
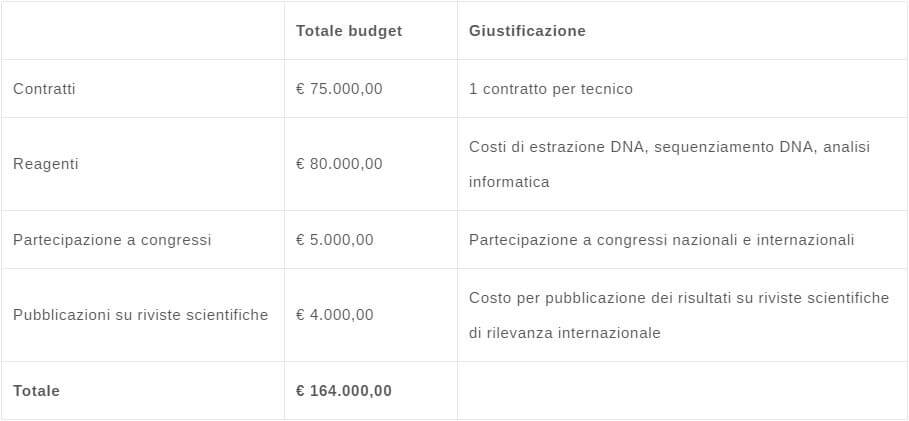
Suddivisione dei Costi

Via Andrea Laurogrotto, 19
84135 Salerno
Presso Ospedale Pausilipon
Via Posillipo, 226 – 80121 Napoli
Codice Fiscale
95086500659
Via Andrea Laurogrotto, 19
84135 Salerno
Presso Ospedale Pausilipon
Via Posillipo, 226 – 80121 Napoli

Con il patrocinio del
Comitato Notarile
della Regione Campania
Associazione Oncologica Pediatrica e Neuroblastoma OdV – OPEN ETS
Monte dei Paschi di Siena – Fil. 1
Corso Vittorio Emanuele – Salerno
IBAN IT50C0103015200000003261242
Banco Posta
Ass. OPEN ONLUS
IBAN IT64G0760115200000043640515
Allianz
IBAN IT04 D035 8901 6000 1057 0894 338
Conto corrente postale
Ass. OPEN ONLUS – N° 43640515
Codice Fiscale
95086500659
Associazione Oncologia Pediatrica e Neuroblastoma OdV – OPEN ETS © 2024 – Tutti i diritti riservati – Privacy Policy – Cookie Policy